光れ線虫
マツ材線虫病(研究ファイル)を引き起こすマツノザイセンチュウ(以下,線虫)は,マツの枝から樹体内に侵入した後,樹体全体に分散しながら増殖して宿主を枯死させます.そのため,マツ材線虫病の枯死機構を解明するためには,樹体内の線虫の動態を詳細に把握し,そこで起こっている反応との対応を明らかにすることが重要だと考えています.
樹体内における線虫の動態は,線虫を苗木に接種した後に,樹体内の線虫の分布を経時的に調べることで推定できます.線虫の分布を調べるには,線虫を接種した苗木を細かく切り分けて,それぞれの材片に含まれる線虫数をベールマン法(材片を水に浸して線虫を分離する手法)により測定するのが一般的です.しかしこの方法では,線虫のおおまかな分布はわかりますが,組織ごとの詳細な分布はわかりません.また,組織切片を作成し,酸性フクシンやサフラニンで線虫を染色して,光学顕微鏡で観察する方法もありますが,これらの色素は植物組織も染色してしまうため,線虫を見分けるのに労苦を伴います.
そこで私たちは,組織切片中の線虫を特異的に染色する方法を検討し,蛍光物質で標識したWheat germ agglutinin(小麦胚芽凝集素,F-WGA)で染色する方法を確立しました.WGAは,レクチンというタンパクの一種で,N-アセチルグルコサミンなどの糖鎖に結合する性質を持っています.菌類の細胞壁に含まれるキチンは,N-アセチルグルコサミンが重合した多糖類なので,F-WGAにより菌糸を染めることもできます(研究ファイル).
菌で培養した線虫をF-WGAで染色すると,メスの陰門蓋(交尾器)のみが染まりました(図1-a, b).一方,菌で培養した線虫をマツに接種すると,F-WGAにより全身が染色されるようになりました(図1-c, d).全身が染色される線虫の割合は接種初期には低く,接種後の日数経過に伴い80%まで増加しました.このように,染色される線虫の割合が接種後の日数により異なることは,組織内の線虫の分布を正確に観察するツールとしては不適切です.さらに検討した結果,一度マツに接種してF-WGAに染まるようになった線虫を再び接種することで,接種後の日数に関わらずF-WGAで染まる線虫の割合を一定にすることができました.
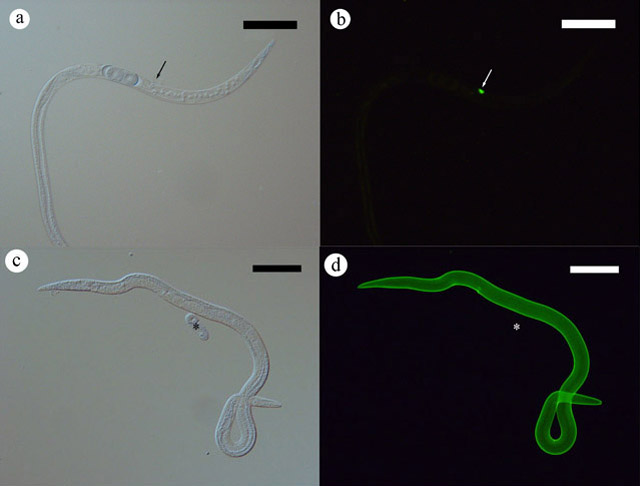
図1. F-WGAで染色したマツノザイセンチュウの顕微鏡像.a,b:菌で培養した線虫.c,d:マツに接種した後に分離した線虫.a,c: 可視光,b,d:蛍光視野像.矢印は陰門蓋を,*は卵を示す.バーは100μm.
このようにして“光る”ようになった線虫を接種したマツ組織切片の写真を,図2に示しました.可視光で観察した場合には線虫を見分けるのは難しいですが(a),F-WGAで染色してから蛍光顕微鏡で観察すると線虫を容易に識別できます(b).この手法の確立により,線虫の組織ごとの分布を詳細に調べることが可能になりました.
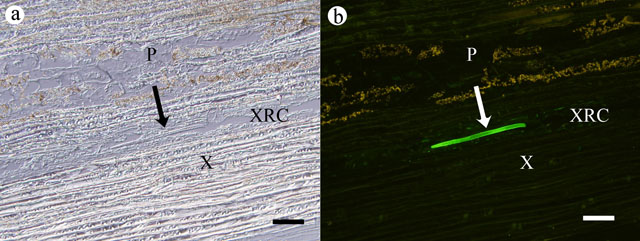
図2. F-WGA染色を行った接種1日後のクロマツ切片.a:可視光,b:蛍光視野.P:髄,X:木部,XRC:木部樹脂道,矢印:線虫,バーは100μm.
2010.4.27
小松雅史
論文:
Komatsu M, Son J, Matsushita N, Hogetsu T (2008) Fluorescein-labeled wheat germ agglutinin stains the pine wood nematode, Bursaphelenchus xylophilus. Journal of Forest Research 13:132-136